sur Nanohale AG (isin : DE000A1EWVY8)
La Commission européenne approuve le biosimilaire FYB202/Otulfi® de Formycon et Fresenius Kabi
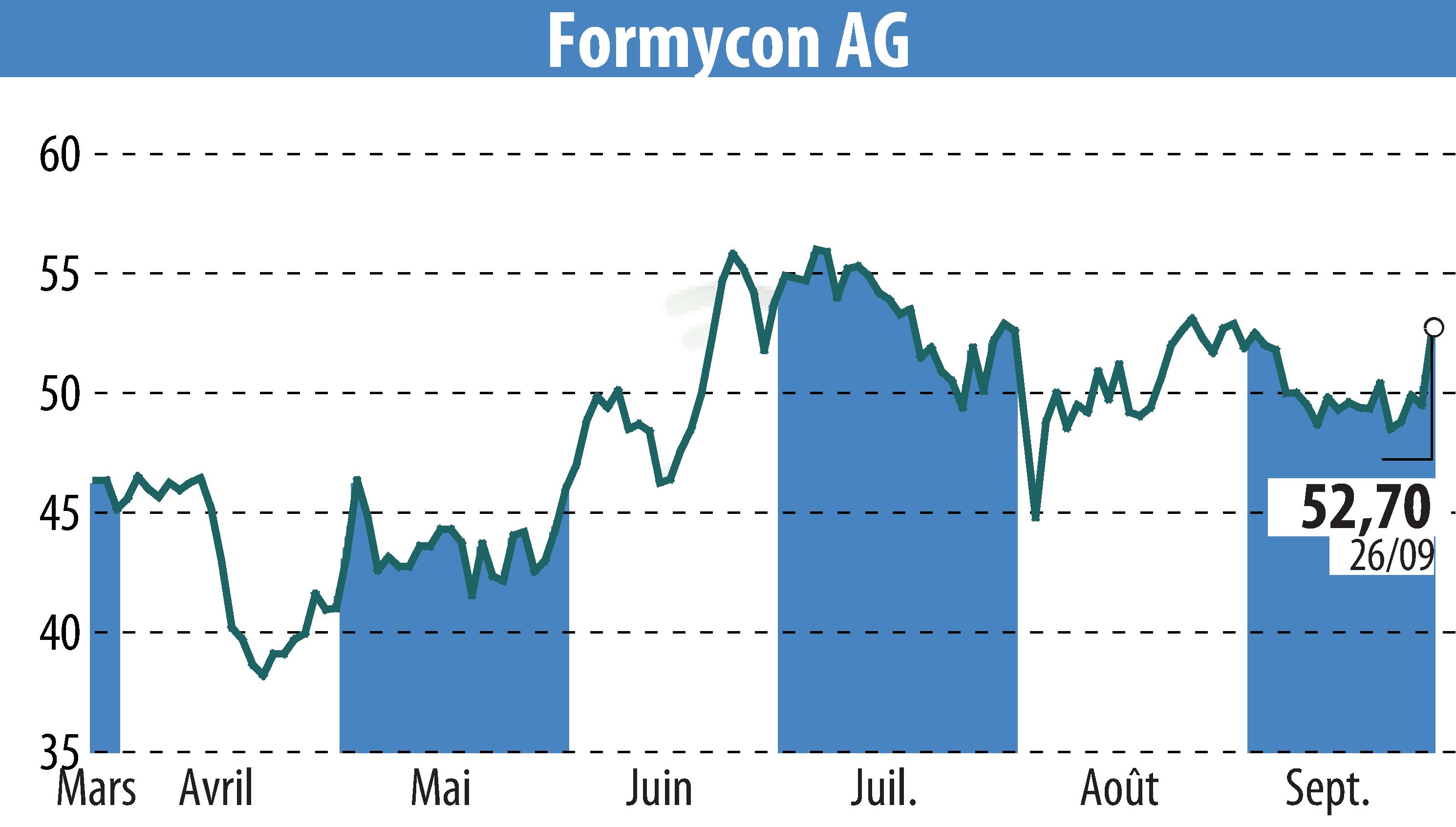
Formycon AG et son partenaire Fresenius Kabi ont reçu l'approbation de la Commission européenne pour FYB202/Otulfi®, un biosimilaire de Stelara®. L'approbation couvre à la fois les formulations sous-cutanées et intraveineuses, destinées au traitement de la maladie de Crohn modérément à sévèrement active, du psoriasis en plaques modéré à sévère et de l'arthrite psoriasique active.
L'approbation fait suite à un avis positif du Comité des médicaments à usage humain en juillet 2024. La décision est basée sur des données complètes, notamment des évaluations analytiques, précliniques, cliniques et de fabrication. FYB202 a montré une efficacité et une sécurité comparables à celles de Stelara® lors des essais cliniques.
Formycon et Fresenius Kabi ont conclu un accord de licence mondial pour FYB202, les droits semi-exclusifs pour certaines régions restant la propriété de Formycon. Stelara® est l'une des marques de médicaments les plus importantes d'Europe, avec des ventes dépassant les 2,5 milliards d'euros par an.
R. E.
Copyright © 2024 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de Nanohale AG
